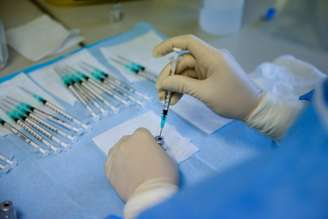
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu neste sábado, 6, o pedido de registro definitivo da vacina da Pfizer contra a covid-19, que recebeu o nome de Cominarty, segundo informações do Ministério da Saúde. Este é o segundo pedido encaminhado à Anvisa para o imunizante contra a covid-19, o primeiro foi o da vacina de Oxford.
Logo após ser concedido o registro definitivo, a vacina poderá ser comercializada, distribuída e utilizada pela população, nos termos da indicação estabelecida na bula.
O processo faz parte da avaliação completa com dados mais robustos dos estudos de qualidade, eficácia e segurança, bem como do plano de mitigação dos riscos e da adoção das medidas de monitoramento.
A Anvisa informa que tem avaliado de forma emergencial e com total prioridade as vacinas contra a covid-19. Segundo a agência, a avaliação estabelece regras a serem cumpridas, afim de garantir que as vacinas sejam seguras e adequadas para imunizar e não causar dano à população brasileira.
Em nota, a Pfizer informou que a submissão contínua junto à Anvisa tem como base dados de segurança e eficácia avaliados de aproximadamente 44 mil participantes do estudo, que foram acompanhados por dois meses, em média, após a segunda dose da vacina experimental.
Segundo a Pfizer, o estudo clínico de fase 3 foi realizado em 150 centros nos EUA, Alemanha, Turquia, África do Sul, Brasil e Argentina. No Brasil, participaram 2.900 voluntários de São Paulo e Salvador.










-1jetbxfaa4o6d.jpeg)