Agência europeia autoriza pílula da Pfizer contra covid-19
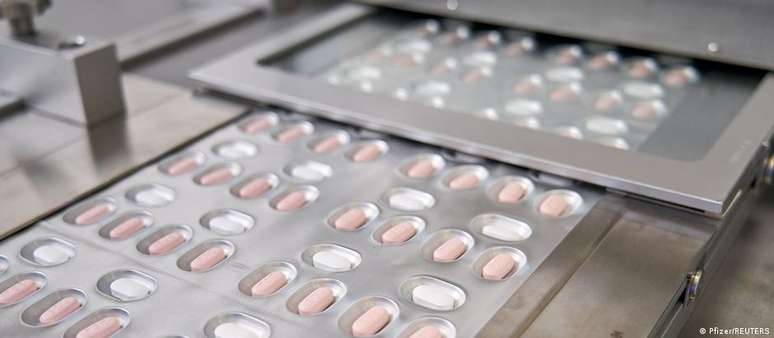
Órgão regulador de medicamentos da UE aprova uso emergencial do Paxlovid. Estudos apontaram que pílula reduz em até 89% o risco de hospitalização e morte. Agência autoriza também outros dois novos tratamentos anticovid.A Agência Europeia de Medicamentos (EMA) autorizou nesta quinta-feira (16/12) o uso emergencial da pílula experimental contra covid-19 da farmacêutica americana Pfizer. Também foram aprovados os usos de outros dois novos tratamentos: um com anticorpos monoclonais e um com imunossupressor.
Na terça-feira, a Pfizer havia anunciado que resultados recentes mostram que seu medicamento, chamado de Paxlovid, reduz em 89% o risco de hospitalização ou mortepela doença em adultos, se administrado nos três dias seguintes ao aparecimento dos primeiros sintomas.
Além disso, a empresa também afirmou que os dados mais recentes confirmam que o medicamento é "um inibidor potente" da variante ômicron do coronavírus.
De acordo com a EMA, o Paxlovid "pode ser usado para tratar adultos com covid-19 que não requerem oxigênio suplementar e que apresentam risco aumentado de progredir para doença grave", e deve ser administrado "o mais rapidamente possível após o diagnóstico".
A pílula é uma combinação de dois medicamentos: o nirmatrelvir, uma nova droga experimental, e ritonavir, um antiviral já existente e usado contra o HIV. O nirmatrelvir atua bloqueando a ação de uma enzima que o coronavírus precisa para se replicar. Já o ritonavir é administrado para retardar a degradação do nirmatrelvir no organismo, aumentando a sua eficácia.
Medicamento com anticorpos
Além do Paxlovid, a EMA aprovou também dois novos tratamentos. Um deles é o uso do medicamento com anticorpos monoclonais Xevudy (sotrovimab), desenvolvido conjuntamente pela gigante farmacêutica britânica GlaskoSmithKline e pela empresa norte-americana Vir Biotechnology. De acordo com a EMA, o tratamento "reduz significativamente a hospitalização e as mortes em pacientes com uma doença subjacente".
Os tratamentos com anticorpos monoclonais são proteínas geradas em laboratório que imitam a reação do corpo a infecções. O Xevudy é o terceiro medicamento desse tipo aprovado pela EMA.
A agência recomenda o uso do Xevudy para adultos e adolescentes (a partir dos 12 anos de idade e pesando pelo menos 40 kg) que não requerem oxigênio suplementar e que apresentam risco aumentado de agravamento da doença.
A aprovação levou em conta um estudo com 1.057 pacientes com covid-19. Após o tratamento com o Xevudy, 1% dos voluntários (6 de 528) foram hospitalizados por mais de 24 horas em comparação com 6% dos pacientes que receberam o placebo (30 em 529 - dois dos quais morreram).
Uso de imunosupressor
Outro novo tratamento aprovado nesta quarta-feira é o uso do imunossupressor Kineret (anakinra), fabricado pela sueca Orphan Biovitrum. De acordo com a EMA, o Kineret pode "diminuir os danos nas vias aéreas inferiores, evitando o desenvolvimento de insuficiência respiratória grave".
O uso é recomendado em pacientes adultos com pneumonia que requerem oxigênio suplementar (de baixo ou alto fluxo) e que estão em risco de desenvolver insuficiência respiratória grave.
Atualmente o Kineret já é usado na União Europeia (UE) para o tratamento de várias doenças, como artrite reumatóide. Em pacientes com covid-19, o medicamento é usado para reduzir a inflamação e, assim, diminuir os danos às vias aéreas inferiores, evitando o desenvolvimento de insuficiência respiratória grave.
Preocupações com a ômicron
As autorizações ocorreram em um momento em que a UE se prepara para um possível aumento de casos da variante ômicron recém-descoberta.
O Centro Europeu para Prevenção e Controle de Doenças (ECDC) disse no início desta semana que "ação forte" é necessária para combater a propagação da variante e alegou que as vacinas sozinhas não são suficientes para conter o surto.
A aprovação final para os três medicamentos depende, em última análise, da Comissão Europeia. O passo, no entanto, é considerado apenas uma formalidade. Até então, a União Europeia já autorizou sete tratamentos contra a covid-19.
le/ek (AP, AFP, Reuters, ots)






-1jxzd2ah8xx6e.png)
-skv2onwrpxrr.jpg)
-1hrpazsvnwu3o.png)