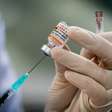
Anvisa forma maioria para aprovar uso emergencial de vacinas
Meiruze Freitas, Romison Mota e Alex Campos votaram a favor das solicitações em reunião extraordinária do órgão regulador
A Agência Nacional de Vigilância Sanitária (Anvisa) atingiu maioria de votos para aprovar o uso emergencial das vacinas da AstraZeneca e da Sinovac contra o coronavírus, em reunião neste domingo, abrindo caminho para o início da imunização no Brasil contra uma doença que já deixou quase 210 mil mortos.
No caso da CoronaVac, da chinesa Sinovac, a relatora dos pedidos, Meiruze Freitas, impôs como condição para o uso emergencial a assinatura pelo Instituto Butantan, autor do pedido, de um termo de compromisso para apresentação de mais dados sobre a vacina até 28 de fevereiro, e a subsequente publicação no Diário Oficial.
Três dos cinco diretores do órgão regulador votaram a favor do uso emergencial de 2 milhões de doses da vacina desenvolvida pela AstraZeneca em parceria com a Universidade de Oxford, que serão importadas da Índia pela Fundação Oswaldo Cruz (Fiocruz), e de 6 milhões de doses da CoronaVac importadas da China pelo Instituto Butantan. Ainda faltam dois votos para término da reunião.
Somente a vacina do Butantan está disponível para aplicação imediata na população no momento, uma vez que houve atraso na importações das doses da vacina da AstraZeneca da Índia.
O Ministério da Saúde solicitou na sexta-feira ao Instituto Butantan a "entrega imediata" das doses da vacina CoronaVac para o início da imunização nacional, mas o governo de São Paulo havia dito que pretendia manter uma parte das doses no Estado para iniciar a vacinação.
Neste domingo, o governador de São Paulo, João Doria, afirmou que determinou que o Butantan entregue imediatamente após a aprovação as vacinas ao Ministério da Saúde.





-1jxzd2ah8xx6e.png)

-1hrpazsvnwu3o.png)